Immunglobuline: Ein Y aus vier Ketten
Die Grundstruktur ist für alle Immunglobuline gleich.
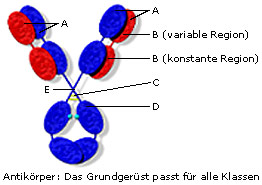 Grundgerüst aus schweren und leichten Ketten (A)
Grundgerüst aus schweren und leichten Ketten (A)
Ein Antikörper besteht aus vier Polypeptidketten. Zwei der Ketten sind jeweils ident und werden als schwere (50-70 kD) bzw. leichte (23 kD) Kette bezeichnet.- Variable und konstante Regionen (B)
Die Aminosäuresequenzen der leichten und schweren Ketten zeigen, dass es zwei verschiedene Regionen – entsprechend der Variabilität der Aminosäurensequenz – gibt.
Die leichte Kette besteht aus einer variablen (VL) und einer konstanten Region (CL). Beide sind etwa 110 Aminosäuren lang.
Die schwere Kette besteht ebenfalls aus einer variablen (VH) und einer konstanten Region (CH), wobei die konstante Region wesentlich größer ist (330 – 440 Aminosäuren) als die variable (110 Aminosäuren). - Disulfidbrücken (C)
Zwischen den schweren und den leichten Ketten gibt es Disulfidbrücken, die die Ketten zusätzlich zu nicht-kovalenten Bindungen zusammen halten. Die Anzahl und Anordnung der Disulfidbrücken variiert zwischen den verschiedenen Antikörperklassen. - Domänen (D)
Innerhalb einer Kette sind Disulfidbrücken für die Ausbildung der speziellen dreidimensionalen Struktur der jeweiligen Kette verantwortlich. Es kommt dadurch zur Ausformung von globulären Strukturen, die als Domänen bezeichnet werden.
Die leichte Kette trägt zwei Domänen, eine in der variablen und eine in der konstanten Region (VL und CL).
Die schwere Kette bildet – je nach Klasse – 4-5 Domänen. Eine in der variablen Region (VH) und 3 oder 4 in der konstanten (CH1-CH4). - Gelenksregion (E)
Der Bereich des Antikörpermoleküls, an dem die schweren Ketten das Y formieren, wird wegen seiner Flexibilität als Gelenksregion (Hinge) bezeichnet. Nur die Antikörper IgG, IgD und IgA weisen spezielle Genorte dafür auf.